今食藥署發布聯亞疫苗EUA專家審查會議記錄,該會議於今年8/15日上午10:00舉行,出席專家共22人,除主席不參與投票之外,有17人不贊同聯亞通過EUA緊急授權,有4人認為可補件再議。毒理專家招名威看了這份會議記錄後表示,他認為聯亞疫苗中和抗體濃度太低,就是未通過的關鍵。
食藥署今發布新聞稿指出,疾病管制署已認定我國疫情及疫苗確有緊急公共衛生情事需求,評並進行估聯亞疫苗之整體利益與風險,並進行聯亞緊急授權EUA專家會議。從數據上顯示,聯亞的疫苗安全性可接受,具細胞免疫反應趨勢,但中和抗體數據與國人接種 AZ 疫苗外部對照組相比,未能達到食藥署在今年5/ 28日時,專家會議所訂我國COVID 19疫苗療效評估基準。出席專家共 22 人,除主席不參與投票, 有4人認為可補件再議、不通過 17 人,因此聯亞未通過緊急授權專案製造。
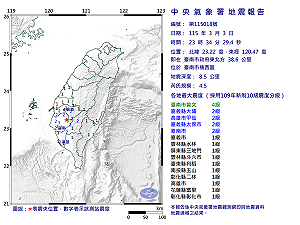
當前熱搜:快訊》23:34臺南市楠西區發生規模4.5有感地震 最大震度臺南市曾文4級
專家A即在聯亞審查會議當中表示,聯亞UB-612疫苗設計與AZ外部對照組GMTR及SRR 2項指標,均未能達標,因此無法合理推估其臨床保護力或療效,故建議不准予專案核准製造。
而專家E表示,聯亞UB-612疫苗中和抗體效價不是很高,反應時效也不是很快,但T細胞免疫反應為其特點。對抗delta病毒株等的優點是未來機會,也期待能獲得聯亞更進一步的相關數據。
專家M表示,聯亞UB-612疫苗在設計上嘗試於抗體反應與T細胞反應取得一個良好的組合,但在第2期試驗結果中和抗體效價偏低,未達公告標準。而聯亞雖提出其中和抗體持續性久,並有許多T細胞反應評估結果,但疫苗注射2劑後的中和抗體效價仍有一定重要性。該專家指出,以以色列研究結果,在真實世界資料中,中和抗體在預防突破性感染上仍有一定重要性,若未產生足夠之中和抗體仍可能造成感染。
當前熱搜:為柯文哲喊冤與賴清德不歡而散? 謝長廷:總統從來沒有找我去問話
針對這分報告,招名威表示,中和抗體數據與國人接種AZ疫苗外部對照組相比,就是未達標。他表示,雖然目前沒有疫苗保護力的比較值,但如同專家M所言,抗體濃度太低在預防突破性感染就較不利。他說明,簡單來說,聯亞UB-612疫苗中和抗體濃度偏低,就仍是未通過緊急授權EUA的重點。