國產高端疫苗一直以來有許多爭議,今食藥署公布了高端首批疫苗審檢成功將進入封緘程序,並同時公開7/18專家針對高端緊急授權(EUA)一案討論的相關會議記錄。指揮中心指揮官陳時中也在記者會上更花了10多分鐘解釋,日前外界對高端未通過EUA即量產的爭議。
陳時中表示,之所以要有EUA就是因為台灣有公共衛生的緊急事件要求,但如果廠商要像一般流程查驗登記後才量產,那就得在等3個月至半年,「這個EUA就會失去了它的效益,所以我們都會要求廠商先做。」
現正最夯:大罷免志工的故事10》從直播間走上街頭--訪山除薇害發言人阿美
陳時中指出,過去藥廠的一般製造流程是在研發、臨床都通過後,才會提出來作查驗登記,查驗登記後藥廠才會開始量產產品,之後再經過檢驗封緘就可以上市。但從去年開始全球皆有公共衛生緊急需求,EUA只是為了加速進行,因此各國在符合科學性的前提下,必需採用很多方法讓行政流程簡化,以利符合公共衛生需求。他進一步指出,去年台灣就成立了專案輔導諮詢團隊,該專案輔導團隊針對申請新藥EUA的專案計畫,為了避免行政文書往返,有時候會直接進到藥廠內;而有時候因為要補件,可直接開會討論校正相關資料,這些都是讓行政流程順暢的方法。
陳時中強調,本次新冠疫苗研發在許多流程上都採重疊式的「平行進行」,讓整體研發速度變快!比如過去的研發有A、B、C3個階段,等A過了再做B,B做過了才做C,陳時中表示,因為每一階段的實驗都須要花很多經費,如果A還沒做完就展開B階段,結果B做一半才發現A階段失敗,B就等於白做,廠商事先投入的錢就浪費了。但在EUA情況下,可能每個階段做到一定程度後,就得開始同步進行下一部分,而這需要投資更多錢,財務風險較高,因此不是每個廠商都願意這麼做,畢竟實驗不會保證一定成功,他以美國為例,說明美國事會先給藥廠一大筆經費,以此要求加速研發,但損失由國家吸收。陳時中表示,台灣的方式就是簽約預採購,先付20~40%定金,假設實驗不幸失敗定金就當作投資,實驗成功當然就繼續往下,這些都是利用這些方法來分攤廠商的財務風險,才能要求廠商加速來做。
因此,陳時中表示,在通過EUA之前,政府會要求廠商先把一些產品先做出來,因為如果廠商要等到EUA過了才開始量產,那相關程序差不多要3個月至半年,「這個EUA就會失去了它的效益,所以我們都會要求廠商先做。」他進一步強調,要求廠商先做,萬一EUA不過,「那我們會付你材料費用,過了當然最好,能即時上市。」
全站首選:中突然贊成朝鮮世襲繼承 美前情治首長:北京希望指導金正恩女兒
陳時中說,疫苗不是做蛋糕,他表示做蛋糕都會失敗,更何況是高科技的東西?高科技產品只要稍微有一點點誤差就不會過了,所以要不斷去修正流程,甚至有時候要重新再做動物實驗。所以在預採購時,陳時中表示都會告訴廠商先量產,政府會一步步去查。陳時中說明,EUA不會因為廠商已經量產了,「所以我就讓你過。」又或者不會是EUA過了,「那廠商量產的我非用不可。」他解釋,因為EUA過了台灣法規上還有檢驗封緘的程序,要一批一批逐步去驗,到市場要是食藥署有封緘的藥品才能上市,沒有封緘的就不行。「有查驗登記、加上有EUA、加上檢驗合格三個條件,才能讓人體注射。」
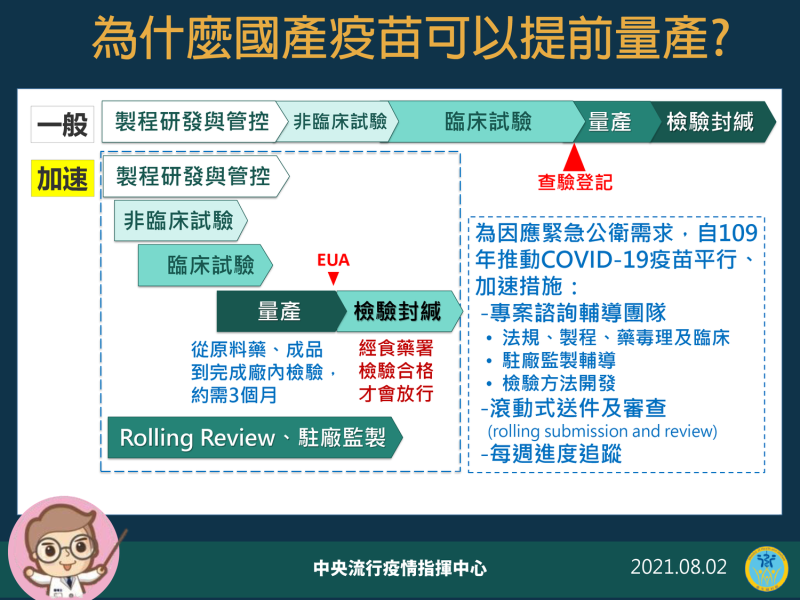
針對國產疫苗提前量產,今指揮中心提出相關說明 圖:中央流行疫情指揮中心/提供














