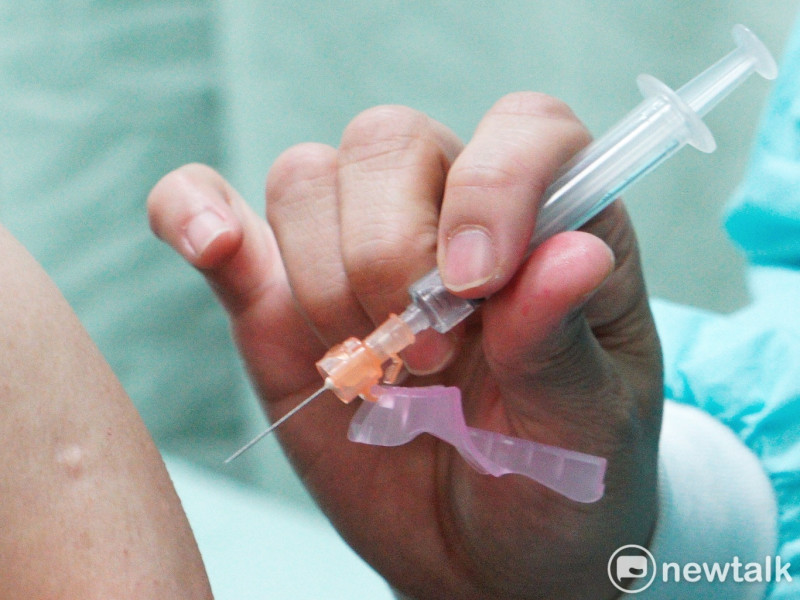
本土新冠確診數不降反升,國內疫苗佈局受矚,研發國產疫苗廠商之一的聯亞生技今(3)日證實,聯亞疫苗2期試驗將於6月中旬解盲、下旬申請緊急使用授權(EUA),盼7月獲准上市。營運長彭文君表示,希望進口疫苗的同時齊頭並進,盡快研發國產疫苗供用。
彭文君指出,疫苗開發要耗費鉅額資金,至少10億美金以上,目前疫苗開發步驟全按政府滾動式審查,其最大的幫助僅是法規上的支持,其餘開發資本多以籌資的方式辦理。
當前熱搜:(影)北捷善導寺站外驚傳隨機攻擊! 失控男子逼近女路人、攔車猛踹
談及疫苗藥效,彭文君表示,聯亞疫苗由蛋白質與生態技術所開發,為高精準設計型疫苗,除B細胞免疫綜合抗體外,還具有T細胞免疫生態成分,無須擔心安全性,有效性也較有保證;若通過EUA,就可透過抗體保護力的估算,得知疫苗的保護力,屆時國際亦會認可聯亞疫苗。
至於12至18歲青少年的試驗,聯亞仍需待獲准EUA方可進行。
另一方面,彭文君也坦言,解盲結果須待月中公布結果後,再統一對外說明,公司會承擔失敗的風險,目前與政府簽定的採購契約僅是訂單,若未獲准EUA,該契約即中止。
如解盲失敗,聯亞則會以另開發、針對變種病毒株設計的疫苗作為備案。
外界質疑疫苗未經3期試驗,彭文君就此說明,係應財團法人醫藥品查驗中心、衛生福利部食品藥物管理署要求專家會議,以擴大2期試驗規模取代3期試驗。彭接續解釋,台灣的確診案例數跟國外比太懸殊,不具進行3期試驗的客觀條件,改以「準三期」進行。