高端昨晚表示,今(10)將依規畫時間公布該公司疫苗2期臨床實驗解盲結果,而食藥署也在今日發布了國內COVID-19疫苗緊急使用授權(Emergency Use Authorization, EUA)的審查標準及相關策略,被外界質疑為高端護航?對此食藥署藥品組組長吳明美表示,這和護航高端一點關係都沒有,和疫苗「療效評估標準」需要一國際疫苗為基準做比對,國內直到3/22號才進口AZ疫苗,該疫苗施打後的保護力檢測就是需要2~3個月才能得知結果,才會選擇在今天公布。
吳明美表示,EUA審查標準去年10月就開始制定,今年上半年已研擬完成,但針對療效評估部分,因為台灣當時與美國疫情差異,很難直接在台灣執行大規模疫苗療效驗證試驗,食藥署於年初即開始思考如何支持國產疫苗療效。
全站首選:分析師敦促輝達投資者「保持冷靜」 25日公布季度財報有望注入股價新活力
因此,當3/22號第一批AZ疫苗在台灣開始接種時,吳明美表示,當時食藥署即委託部立醫院蒐集200位醫護,讓這200醫護全接種AZ疫苗,以AZ療效結果作為與國產疫苗的對照組。吳明美說,AZ施打第1劑後要間隔8-12周才能注射第2劑,施打完第2劑後要待28天產生抗體。隨後抽取施打疫苗者的血液,中研院會將血液送至實驗室,觀察其血液中的抗體對抗新冠病毒。
吳明美指出,這整套流程所需要的天數剛好就是2~3個月,今日食藥署公布EUA審查標準,與取得AZ抗體數據結果有關,與高端疫苗下午解盲完全無關。
吳明美表示,而如AZ疫苗針對台灣人的療效與保護力有多少,也是近來才建立起的資料,她說,國產疫苗有很多大家都不知道的地方,人人都對未知難免有很多疑問,但食藥署只能用科學證據來做審核和審查,「國產疫苗也未必能夠通過這個審查流程,一切都是要看科學證據。」
全站首選:春節狂歡後私密處冒白點!28歲男子擦藥無效快崩潰 醫示警:這病沒疫苗
而據食藥署公布的訂定COVID-19疫苗EUA審查標準,有三大重點:
1.應檢附資料要求
為因應瞬息萬變的疫情趨勢,食藥署已於109年10月召開專家會議研商COVID-19疫苗EUA的審查標準,並參考美國 FDA 於109年10月發布的COVID-19疫苗緊急授權使用指引,訂定「COVID-19疫苗於臺灣取得EUA應具備之技術性資料要求」,為能及時取得安全有效的疫苗預作準備。疫苗廠商申請EUA時,必須檢附疫苗產品的化學製造管制資料、動物試驗資料,以及執行過的所有人體臨床試驗與風險效益評估報告。
2.安全性評估標準
所附臨床試驗報告需有接種試驗疫苗受試者至少3000人於接種最後一劑疫苗後至少追蹤1個月,且所有受試者於接種最後一劑疫苗後追蹤時間中位數至2個月的累積安全性資料,並須包含65歲以上特殊族群之試驗結果。
3.療效評估標準
針對療效評估部分,考量台灣與美國疫情差異,食藥署於第一批AZ疫苗在3月於國內開始接種時,委託部立醫院執行研究計畫,蒐集200位國人接種AZ疫苗之免疫原性結果作為外部對照組,並於5月初起陸續召開專家會議討論,研商以免疫橋接(immuno-bridging)方式,採用免疫原性(中和抗體)作為替代療效指標,衡量國產疫苗誘發產生的免疫原性結果是否與國人接種國外已核准EUA的疫苗相當,作為支持國產疫苗療效的佐證。國產疫苗第2期臨床試驗所得中和抗體效價必須證明不劣於AZ疫苗。國產疫苗和AZ疫苗所有檢體皆由同一個實驗室採用相同方式檢驗,檢驗方法亦以國際標準品共同標定。
食藥署表示,訂定之相關技術性資料要求,均已提供有意研發COVID-19的疫苗廠商做為依循。食藥署強調,對於國產疫苗的製程管控、藥毒理試驗及臨床試驗結果皆會進行嚴謹審查,並經過專家會議審查共識,且需在緊急公衛的需求下,確認疫苗的使用效益大於風險,才會核准緊急授權使用。

食藥署今公布我國Covid-19疫苗之EUA審查標準 圖:食藥署/提供
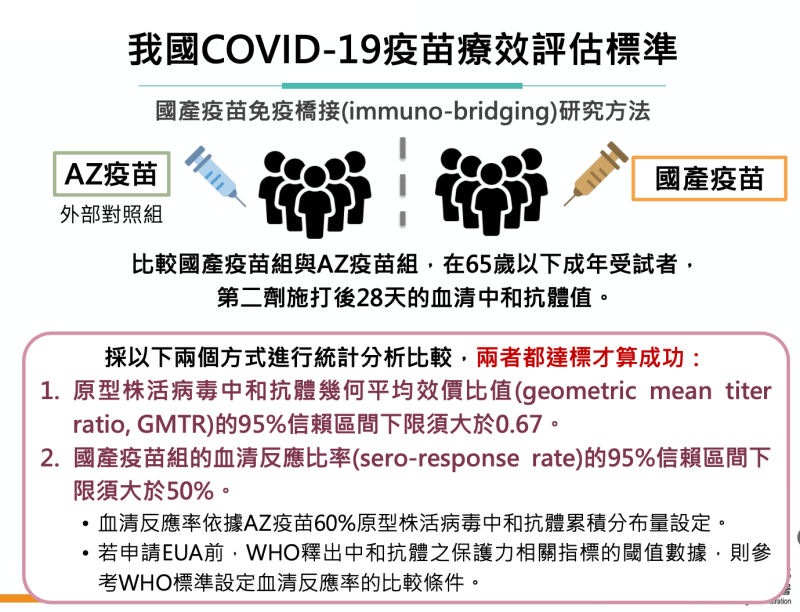
食藥署今公布我國Covid-19疫苗之EUA審查標準 圖:食藥署/提供













