美國製藥、生物技術公司莫德納( Moderna )近期向食品藥物管理局( FDA )提出申請,希望該機構對該公司生產的首款 mRNA 季節性流感疫苗進行審查,但卻遭 FDA 以缺少「充分且控制良好的試驗結果」為由回絕。有美媒分析指出, mRNA 疫苗相關技術已在新冠疫情期間實現應用,並可能大幅提升季節性流感疫苗的有效性,認為此次 FDA 回絕審查申請的決定可能導致相關技術的應用遭到擱置。
根據美國《有線電視新聞網》( CNN ) 報導,當地時間 10 日,莫德納發布公開聲明,宣稱 FDA 已於上周正式回絕該公司對 mRNA 流感疫苗的審查。該聲明指出, FDA 在回絕審查申請的信件中表示,莫德納公司提供的申請資料中缺乏一項「充分且控制良好的試驗結果」,認為試驗的對照組未能反映「美國最佳的治療標準」。
全站首選:基隆警所長「吮指洗車」爆爭議!傳內部抓吹哨者 議員霸氣自招
莫德納表示, FDA 回絕審查申請的理由,與該款疫苗的安全性或有效性問題完全無關,認為該機構採取的行動與先前進行的回饋不一致。莫德納強調,該公司已經提出與 FDA 官員會面的要求,希望透過直接的協商,釐清相關技術的未來審查方向。
報導稱,在此次疫苗的臨床試驗中,莫德納總計召集了 40,700 人,並以季節性流感疫苗 Fluarix 的標準劑量作為對照,試圖證明該公司推出的 mRNA 疫苗具有安全性與有效性。同時,莫德納也採用了 FDA 的建議,將 65 歲以上人群的高劑量流感疫苗對比數據列入試驗中,並在 2025 年 8 月將相關數據送往 FDA 等待申請。
該報導指出,莫德納是美國國內三間獲得批准的新冠疫苗生產商之一,且早在研發新冠疫苗時就已採用 mRNA 疫苗相關技術。該報導強調, mRNA 疫苗技術是美國總統川普在第一任期期間達成的主要成就之一,但川普卻在第二任期取消了對相關技術的支持,並刪除了 22 個價值約 5 億美元 (折合新台幣約 157.15 億元) 的 mRNA 疫苗研發項目,進而導致相關技術的發展受阻。
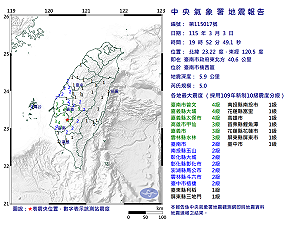
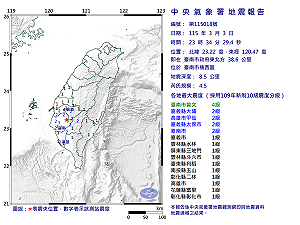
當前熱搜:快訊》19:52臺南市楠西區發生規模5.0有感地震 最大震度臺南市曾文、嘉義縣大埔、嘉義縣太保市4級
該報導表示,與需要提前幾乎一年預測流行毒株製造的一般疫苗不同, mRNA 疫苗幾乎可以到 5 、 6 月份再篩選可能流行的毒株,並實現 8 月推出疫苗的目標,具有高度的有效性。另一方面, mRNA 疫苗也能透過定製的方式,依照不同病毒的流行區實現應用,甚至可與新冠疫苗聯合使用,讓民眾只接種一劑疫苗就能同時預防兩種病毒。
該報導也引用莫德納公司的臨床試驗數據稱, mRNA 技術疫苗在 50 歲以上成年人群體中的有效性,比 Fluarix 高出 27% 。即使是 65 歲以上的高齡群體, mRNA 疫苗也比傳統疫苗更具優勢。
莫德納總裁史蒂芬.霍格 ( Stephen Hoge ) 博士接受《CNN》專訪時指出,莫德納原先計畫在 FDA 開始對 mRNA 流感疫苗進行審查後,推動流感與新冠病毒的 mRNA 聯合疫苗的審查,「但由於 FDA 拒絕了此次的審查申請,我們被迫等待 FDA 的進一步指導,後續的規劃也因此遭到擱置」。霍格強調, mRNA 疫苗技術可能在今年得到國家級的認可,「我們認為很可能是歐洲國家,這對人類的傳染病防疫將成為一次里程碑式的事件」。