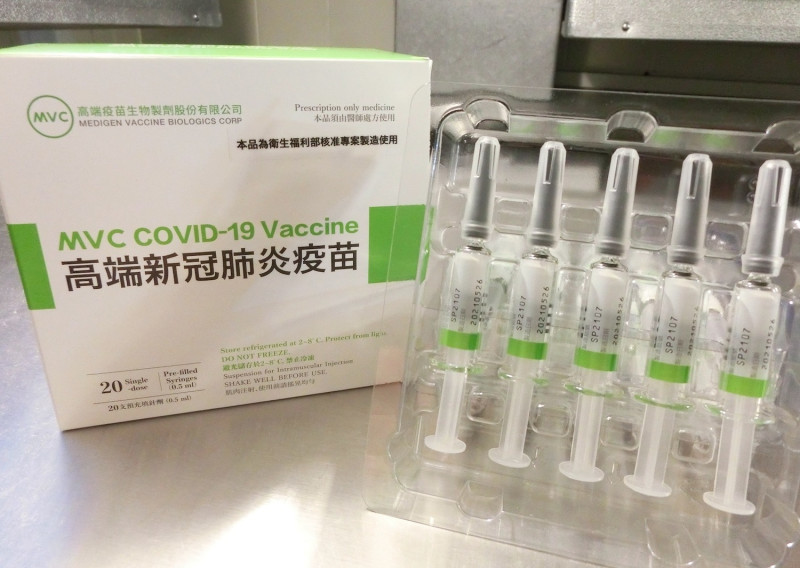
日本開放國境後, 因入境檢疫規定的疫苗認證名單裡沒有台灣本土研發的高端疫苗,引發不少爭議。今高端發出聲明稿指出,日本入境檢疫要求並非藥證,不屬於廠商主動申請,而因高端已於九月份提供疫情指揮中心相關文件。至於國際認證相關進度與爭議, 高端也在聲明稿中一一提出說法。
針對日本目前入境檢疫規定僅接受 WHO 緊急使用清單(EUL) 之新冠疫苗接種證明,並不包含已取得台灣 EUA 的高端疫苗。高端表示, 雖其公司研發新冠疫苗依循台灣法規單位之標準進行開發,為台灣認可之正式 EUA 疫苗,但日本入境檢疫要求並非藥證申請審查,並不屬於廠商主動向日本政府藥監單位提出申請之事項,因此,高端疫苗已於九月份提供疫情指揮中心相關文件,並陸續提供其他補充資料,協助政府部門進行溝通,高端也將配合台日雙方政府之持續協商,希望能盡快提供民眾更便利的赴日旅遊方式。
全站首選:大罷免志工的故事10》從直播間走上街頭--訪山除薇害發言人阿美
至於國際認證進度部份,高端入選WHO 團結試驗疫苗(STV) 一事,皆由 WHO 主導執行全球臨床3期,目前靜待其公佈臨床結果;此外,高端疫苗也自行於國外執行免疫橋接3期試驗。
高端也強調, 因為台灣政治處境特殊,台灣本土疫苗廠欲取得國際認證之難度遠高於其他國外疫苗公司。而因台灣並非WHO成員國,高端疫苗無法於取得台灣認證後直接申請WHO認證,需經第3國藥監單位的協助才得以提出申請。目前高端已向澳洲藥監單位 TGA 及 WHO 相關主管部門,正式提出申請緊急使用許可,如有任何進度更新,即依法規公告。
至於疫苗保護效益(effectiveness)報告,高端新冠疫苗於 2021 年取得台灣緊急使用授權 (EUA) 時,衛福部食藥署要求於今年(2022)檢送疫苗保護效益(effectiveness)報告,高端表示也已如期繳交,並於專家會議上報告說明。日前收到食藥署審查補件要求後,已積極準備相關資料,將依要求及規範如期於 10 月底完成補件。