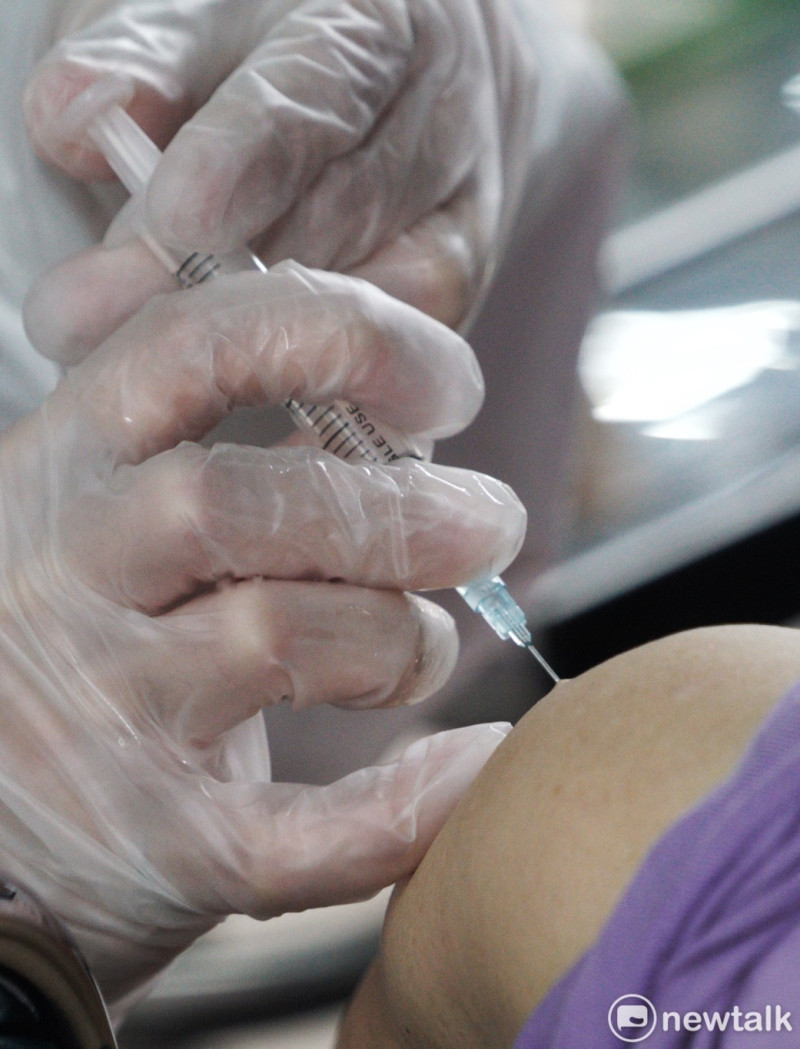
國光生物科技宣布,向印尼食品藥物管理局(BPOM)申請新冠肺炎疫苗AdimrSC-2f vaccine第1/2期海外人體臨床試驗,已獲正式核准,預計將收案300人左右。面對新冠病毒變異株,國光生技表示將調整新冠疫苗開發策略,發展最適用的次世代疫苗。
國光生表示,因全球陸續完成第一階段的疫苗施打,面對新冠病毒不斷變異,國光生技也將調整新冠疫苗開發策略,並同時追蹤分析病毒株變異趨向,發展最適用的次世代疫苗,升級的次世代疫苗將作為長期防疫準備,並同時順應符合國際市場新冠疫苗加強劑的需求。
當前熱搜:美以空襲擊斃哈米尼 中俄北韓齊轟「違反國際法」中東情勢急升溫
因目前印尼正處delta變異株流行高峰,因此於印尼進行臨床試驗可取得疫苗保護力數據,國光生表示,這也是國光次世代疫苗臨床開發選擇印尼為起點的原因。而若都順利,國光生說明也將以此基準進行第3期人體臨床試驗,以符合國際規範、可對抗變種病毒的新冠疫苗作為開發策略搶進市場。而在海外進行的臨床試驗不以申請緊急授權許可(EUA)為目的,將會按步就班完成三期臨床試驗。
國光新冠疫苗臨床試驗將由印尼日惹大學(Universitas Gadjah Mada)醫學院醫師主持,預計2期臨床試驗將收案300人。試驗目的將確定劑量並驗證疫苗具完整保護力,預估結果明年出爐。