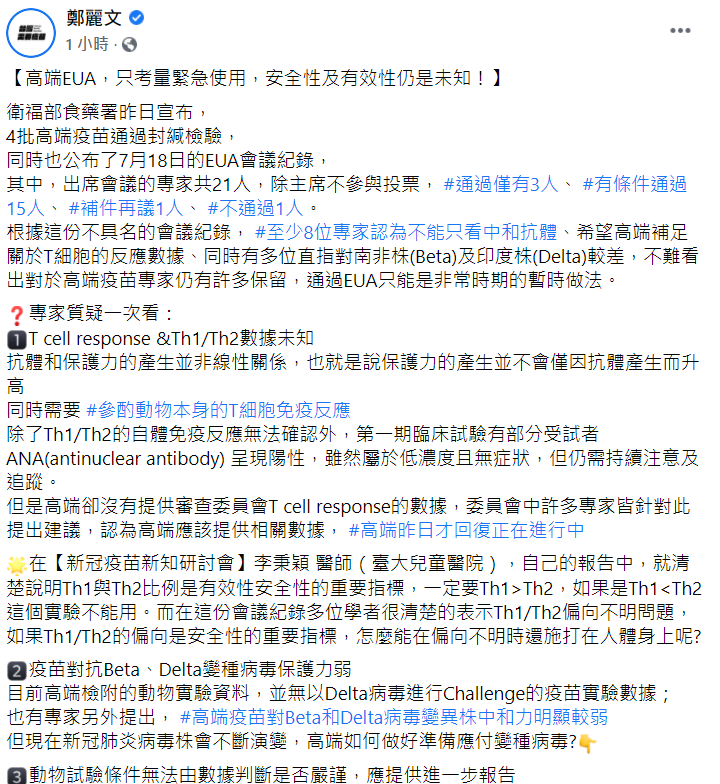
國民黨立法委員鄭麗文今 (3) 日在臉書發文說,衛福部食藥署昨 (2) 日宣布,4批高端疫苗通過封緘檢驗,同時也公布了7月18日的EUA會議紀錄,出席會議的專家共21人,除主席不參與投票外, 通過僅有3人、有條件通過15人、 補件再議1人、 不通過1人。
鄭麗文指出,根據這份不具名的會議紀錄, 至少8位專家認為不能只看中和抗體、希望高端補足關於T細胞的反應數據、同時有多位直指對南非株 (Beta) 及印度株 (Delta) 較差,不難看出對於高端疫苗專家仍有許多保留,通過EUA只能是非常時期的暫時做法。
當前熱搜:鄭麗文稱「美國是恩人」 張亞中痛罵「奴僕心態」還要求道歉
此外鄭麗文列出九點專家對於高端疫苗的質疑。
第一點是,T細胞反應 &Th1/Th2數據未知。抗體和保護力的產生並非線性關係,也就是說保護力的產生並不會僅因抗體產生而升高,同時需要參考動物本身的T細胞免疫反應,除了Th1/Th2的自體免疫反應無法確認外,第一期臨床試驗有部分受試者 ANA (antinuclear antibody) 呈現陽性,雖屬低濃度且無症狀,但仍需持續注意及追蹤。
但高端卻沒有提供審查委員會T細胞反應的數據,委員會中許多專家皆針對此提出建議,認為高端應該提供相關數據, 高端昨日才回復正在進行中。
現正最夯:(影)中國要內戰了?張又俠被捕後 各地解放軍部隊湧向北京畫面瘋傳
第二點,疫苗對抗Beta、Delta變種病毒保護力弱。目前高端檢附的動物實驗資料,並沒有以 Delta 病毒進行Challenge 的疫苗實驗數據;也有專家另外提出, 高端疫苗對Beta和Delta病毒變異株中和力明顯較弱,但現在新冠肺炎病毒株會不斷演變,高端如何做好準備應付變種病毒?
第三點,動物試驗條件無法由數據判斷是否嚴謹,應提供進一步報告。恆河猴試驗中佐劑使用兩倍的量,跟人體試驗不同,且佐劑組與疫苗組的恆河猴數量減少,鄭麗文認為這需說明原因。以及倉鼠病毒感染造成體重明顯下降,但高劑量或低劑量疫苗組,體重則短期增加及試驗控制組出現肺部發炎情形,小鼠 (AAV/hACE2 mice) 試驗無法評估疫苗佐劑最佳劑量。
第四點,中和抗體效價高低不等於疫苗實際保護力,高端疫苗保護力未知。食藥署針對國產疫苗中和抗體效價訂定的標準是「至少95%的國產疫苗受試者抗體,須達到注射AZ疫苗者的三分之二水準」,而最終公布高端的數據是「至少95%施打高端疫苗者抗體濃度達到AZ疫苗組的3倍」。但民眾僅能從中和抗體「 推估」高端疫苗的保護效力介於莫德納和AZ之間,實際保護力仍是未知,會議中更有超過10位以上的專家建議高端應完成三期臨床試驗。國際上就有失敗案例,德國廠商CureVac疫苗,二期抗體數字漂亮,但在4萬人身上進行的三期試驗結果,顯示接受兩劑CureVac疫苗的人保護力僅有47%。
第五點,不良反應未知。高端缺乏針對孕婦及其他弱體族群的實驗數據,且不良反應在給予委員會的仿單擬稿上面並沒有寫得很明確。縱使次單位蛋白疫苗的特點是副作用小,審查委員仍提醒: 有些罕見的副作用仍需特別考量!
第六點,巴拉圭三期試驗問題,高端打算在友邦巴拉圭進行三期試驗,預計三期人體臨床試驗於今年第3季完成所有受試者收案,然而受試人數僅有1,000人,受試者人數過少,是否能反映疫苗罕見發生情況令人擔憂。且另一方面,雖然疾管署要求高端進行三期試驗,但未來高端的三期試驗將以「 免疫橋接」為目標進行,即使WHO在5月26會議中提到未來「有可能」開放免疫橋接,但目前沒有足夠的數據支持,且尚未制定出一個標準,審查會議中也有高達7名專家表示「 免疫橋接無法代表真實的保護力」。 (歐盟認為在一定條件下可以接受免疫橋接取代三期臨床試驗,美國FDA卻表態不認可) 。免疫橋接能否取代三期試驗還有待驗證。
第七點是,疫苗品質不一致,安定性備受質疑。在提供給學者的資料中,有2批次液酸醣基化程度 (sialylated glycan %) 與其他批次不太一樣,所以專家要求對安定性持續觀察,且逐批都要進行檢驗。雖然高端在8月2日說明「唾液酸醣基化修飾不影響疫苗免疫原性」,但這樣的情況是否疫苗在研發中預期會發生的製作誤差問題,還是事暴露疫苗製造品質不穩定情況。
第八點,疫苗長期保護力證據不足。在長期保護力方面,審查委員提出高端目前提交臨床試驗抗體持續性證據,顯示抗體在 2 個月內可維持效用尚可接受,但施打疫苗目的為產生長期的保護力尚未有足夠證據可支持。同時高端已完成的第一期臨床試驗中,接受第三劑追加施打者人數少、且與接種第二劑時間間隔長,高端應補上第一期試驗的第三劑追加數據,持續觀察 3 至 6 個月的抗體變化以評估長期保護力。
最後第九點,EUA是基於緊急公衛情事,無法保證疫苗的有效性及安全性。審議過程中, 通過的僅有3人,其他專家不是「 有條件通過」,就是要求補件再議或直接否決。
鄭麗文認為在給學者討論的題目中,疾管署已經給了前提「我國疫情確有緊急公共衛生情事需求」,要學者討論「高端疫苗整體利益風險,是否符合藥事法48-2條緊急授權規定」,所以告訴學者:「我們現在就是需要疫苗,可是國內沒有疫苗,高端給不給過?」
鄭麗文質疑,這是否暗示學者只要疫苗利大於弊就「將就一下」? 高端疫苗審查,通過的也只有3位專家,7成 (15位) 的專家是有條件通過,一位是認為補資料之後再議,一位是直接否決。在整體的討論中,也看到專家不斷提到,只能在疫情指揮中心成立期間使用,高端疫苗只是緊急情況不得已的方式。

國民黨立委鄭麗文。 圖:黃建豪/攝
國民黨立法委員鄭麗文今 (3) 日在臉書發文,列出九點專家對於高端疫苗的質疑。 圖:翻攝自鄭麗文臉書