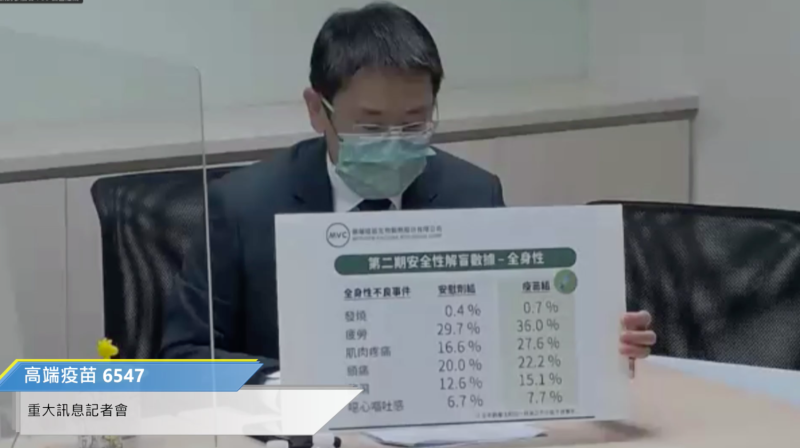
高端今日下午17:00舉行記者會,公布該公司疫苗解盲結果。而根據該公司執行副總兼發言人李思賢在記者會上所公布的數據顯示,在超過4000人規模的臨床試驗當中,高端疫苗顯示出的安全性與耐受性皆良好,且中和抗體幾何平均效價都算高,而試驗者中也有高齡89歲的長者,而在追蹤一個月的接種者現象,並沒有太大的不良反應,甚至發燒部份比例也小於1%,為0.7%,可說非常低,高端指出這是非常安全性的指標。
高端今於記者會中指出,高端新冠肺炎疫苗二期臨床主試驗,於今年1月22日開始第一位受試者疫苗施打,並於4月28日完成所有受試者第二劑疫苗接種。
根據藥物主管機關的技術性要求與試驗設計,此臨床試驗已於5月28日達到所有受試者第二劑疫苗施打後一個月、以及中位數受試者追蹤二個月的期間分析條件。
受試者血清也依照官方要求,由中研院P3實驗室檢測野毒中和抗體效價,並已完成檢測。臨床試驗中心及中研院等相關合約實驗室,已於五月底將期間分析之所有相關原始資料,在盲性狀態下,上傳至第三方臨床試驗受託機構:美商CRO公司Clinipace,進行數據彙總整理與分析。於6月10日下午1點召開由獨立科學專家組成的IDMC獨立數據監測委員會(Independent Data Monitoring Committee)會議,進行期間分析解盲。
高端新冠肺炎疫苗,在這期間分析數據顯示:
1.安全性與耐受性良好:所有受試者未出現疫苗相關嚴重不良反應。甚至所有受試者發燒狀況不到1%,這是非常安全的指標。
2.在免疫生成性部分,不區分年齡組情況下,疫苗組在施打第二劑後28天的血清陽轉率(seroconversion rate)達99.8%;中和抗體之幾何平均效價(GMT titer)為662,GMT倍率比值為163倍增加。而20~64歲之疫苗組,血清陽轉率則為99.9%,中和抗體幾何平均效價(GMT titer)為733,GMT倍率比值為180倍增加。
高端表示,高端的新冠肺炎疫苗以次單位重組蛋白平台進行開發,以S-2P抗原搭配鋁鹽與CpG1018佐劑,製成疫苗成品。而S-2P抗原平台技轉自美國國衛院,S意指新冠病毒棘蛋白部位、2P則為對棘蛋白的兩個脯氨酸(proline)進行基因修飾,使S-2P疫苗抗原能以「融合前構型 (prefusion)」、以及「三聚體結構 (trimer)」穩定呈現。目前歐美已上市的mRNA疫苗或腺病毒疫苗的抗原構型,亦大都有與S-2P相似的基因修飾。
而佐劑則可幫助抗原吸附以維持疫苗穩定,增強免疫反應,以及誘導免疫偏向。高端新冠肺炎疫苗選用鋁鹽與Dynavax CpG1018作為搭配,此佐劑組合已驗證具備良好的Th1免疫偏向,且經美國FDA核可,並有多年使用經驗,使疫苗開發過程有更多安全性評估數據,加速新冠肺炎疫苗開發速度。
臨床試驗設計部分,高端表示,依藥物主管機關的要求,第一期臨床試驗已提前完成疫苗劑量選定。目前國內執行的二期試驗,依法規單位要求,以第一期試驗選定的單一固定劑量進行,並要求疫苗組受試者人數至少3,000人,以評估千分之一的非預期性不良反應發生率;且此二期試驗採用雙盲、安慰劑對照,並要求納入疫苗製程的三批次一致性評估,以確認疫苗製程開發的品質穩定。
高端指出,基於藥物主管機關的技術性要求下,高端臨床試驗以4000人規模為就,並在全國11家臨床試驗中心,百名醫護全力投入,以及超過4000名志願受試者的積極參與下,6月10日的期間分析,共計涵蓋3815名有效受試者,最高齡受試者達89歲。並以所有受試者兩劑疫苗施打完成後一個月,以及中位數受試者完成疫苗施打後2個月的數據,進行安全性與免疫生成性評估。