美國獨立專家小組今天投票,一致贊成推薦嬌生公司的2019冠狀病毒疾病(COVID-19)單劑疫苗緊急使用授權,可望為美國第3款疫苗獲准鋪路,不久即可開始配送。
由美國食品暨藥物管理局(FDA)所召集的專家小組22名成員,包括頂尖科學家、消費者與產業界代表。他們的推薦雖不具約束力,但意見通常會被採納。
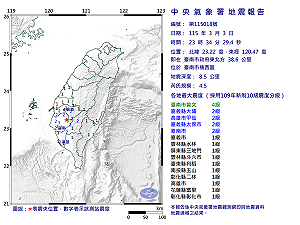
全站首選:快訊》23:34臺南市楠西區發生規模4.5有感地震 最大震度臺南市曾文4級
法新社報導,也許就在未來幾天內,FDA可能核准緊急授權使用(EUA),讓嬌生(Johnson & Johnson)疫苗成為繼輝瑞大藥廠(Pfizer)和德國BioNTech共同研發的疫苗以及莫德納(Moderna)疫苗之後,美國第3支核准使用的疫苗。
美國主管官員本週表示,他們希望下週能配送300萬到400萬劑疫苗。