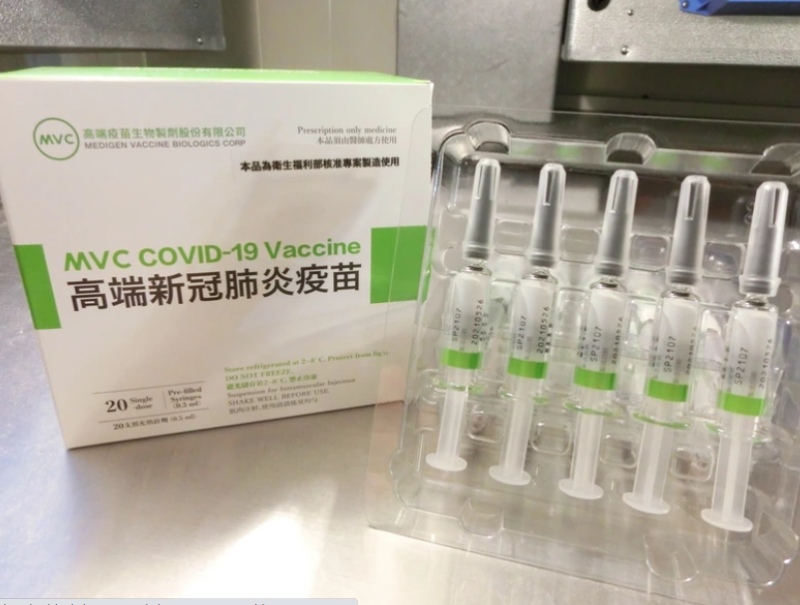
衛福部食藥署2日公布高端疫苗緊急使用授權(EUA)審查會議紀錄,與會多數專家都質疑對Delta等變種病毒保護效果,認為高端疫苗需繼續進行第三期或第三劑追加試驗,並須確認中和抗體以外的免疫效果,如T細胞反應等。而毒理學專家招名威表示,台灣現在確診病患不足,也無法完成完整的三期試驗。不過高端既可出貨,對於目前總到貨量僅9百萬劑疫苗的台灣來說,確實是一陣及時雨。招名威呼籲:「不要再用『自己的想像』和『人云亦云的態度』去看待專業性的議題」。
招名威在臉書Po文提到,報告中提及不僅是台灣,目前世界疫苗供應都非常吃緊,疾管署疫苗採購分三種不同方式,分別向國際組織(COVAX)、國外廠商、及國內廠商購買,不含捐贈,預計採購總劑量為 2981 萬劑。但即使預採購疫苗,供應量都完全不足且交貨落後,觀察越南就知道了,只有美國和日本捐贈的幾百萬劑疫苗,訂單到目前為止疫苗都還停在只下單,未到貨的階段,所以高端疫苗現階段確實是符合台灣EUA緊急授權使用的範圍內。
全站首選:台灣「酷澎」也傳個資洩漏 數發部:台韓資料庫用同一個金鑰
日前有媒體稱高端的武漢肺炎疫苗有8成產能被退貨,招名威說明,第一位專家的審查意見就反映出這個問題了,不過依據高端提供2L和50L批次間的比對試驗結果,除最初試量產的2批次唾液酸醣基化程度(sialylated glycan %)與其他批次結果有差異外,其餘批次的結果相近,該專家建議廠商持續監測疫苗批次醣基化程度,以確認合理的允收範圍,並確保批次間品質一致。
關於疫苗安全性及副作用方面,招名威指出,第一期臨床試驗中有觀察到少部分受試者的ANA(antinuclear antibody)呈現陽性,雖然體內濃度極低且沒有明顯症狀表現,但未來若大規模施打,問題很快就會被放大,應該要持續完整追蹤這些個案血中ANA數值的後續變化,畢竟ANA呈現陽性可能連結到的疾病包括全身性紅斑性狼瘡、進行性全身性硬皮病、乾燥症候群、多發性肌炎、皮膚肌炎、混合性結締組織病及自體免疫肝炎等。
關於功效性方面,招名威續指,大致上專家都是以可接受做意見,畢竟抗體的產生及後續抗體中和表現都相當高,特別是在15mcg二劑量接種 28 天後,可產生高反應的中和抗體和抗原特異性,且與接種AZ疫苗的對照組相比,在中和抗體的評估上都是有超水準的表現,整體滿足當初一開始專家會議的要求,但他們也是有一些需要補強的地方,像是有專家就說缺乏臨床保護力指標(CoP),而且中和抗體檢測只是評估方法之一等。
當前熱搜:卓榮泰不副署黨產條例等3法 民眾黨團:毀憲亂政 民意會嚴厲反撲
對此,招名威認同專家說法,因為疫苗的最終保護力並非全部來自中和抗體,免疫力提升無法只以T細胞免疫反應就代表全部,是還需要提供更多有力證據的,除了需要再驗證對中和抗體效價的持續性(抗體可以持續多久)之外,還是要盡快執行臨床三期傳統療效的驗證才能證實其保護力,他相信這也是高端佈局中南美洲的原因之一,畢竟台灣現在確診病患不足,也無法完成完整的三期試驗。
招名威最後強調:「專家之所以專業度高過於一般人,你給他100,他就是會要求120!但苛求總比放水好,基本上,我相信國產疫苗廠的努力和用心,我更相信食藥署的專家水準,我認為有嚴謹的制度,才會有好的審查標準,這樣產生出來的藥品才可以解決我們的問題,不要再用『自己的想像』和『人云亦云的態度』去看待專業性的議題,這些都是毒素,太多對全台灣的人民都沒有好處。」